- 再発転移がん治療情報
- 再発転移のがん治療を知る
- その他治療
- 【最新医療】大腸がん幹細胞を狙い撃ちする治療モデルの開発に成功――慶應義塾大学
【最新医療】大腸がん幹細胞を狙い撃ちする治療モデルの開発に成功――慶應義塾大学
目次
がん幹細胞が生き残って再発や転移を起こす
大腸がんの再発・転移に関与すると考えられる「がん幹細胞」の機能が明らかになり、「がん幹細胞」を標的にした治療モデルが開発されました。慶應義塾大学の消化器内科(佐藤俊朗教授)の研究グループがマウスを使った実験に成功し、科学誌「Nature」に研究成果を報告しました。
正常の大腸の組織には幹細胞が存在し、自分自身と同じ幹細胞の複製を無限に繰り返すとともに、分化細胞も生み出すことが知られています。
「分化」とは、細胞が分裂して成熟していくことです。分化の進み具合は分化度といわれ、成熟の度合いに応じて、未分化、低分化、高分化などと表現されます。細胞は未分化、低分化、高分化の順に成熟していきます。未分化は細胞がどの器官、臓器にもなっていない未熟な状態です。分化度の低い(未分化、低分化)細胞は活発に増殖する傾向があります。
がん細胞も同様の過程で成熟することが知られています。特に未分化がんは、どの細胞から発生したかということさえ確認できないほど情報に乏しいがん細胞で、増殖が速く、悪性度はもっとも高くなります。
抗がん剤や放射線の治療で大半のがん細胞は死滅しますが、がん幹細胞は生き残り再びがん細胞が増殖して再発や転移を引き起こす原因になります。がんの完治が難しいといわれるのはこのためですが、がん幹細胞の根治療法を開発することはがんの再発や転移の克服につながると考えられています。
がん幹細胞の遺伝子発現を可視化
正常な組織の幹細胞だけが発現するLGR5という遺伝子があります。一方、分化細胞は KRT20という遺伝子を発現すると考えられています。大腸がんも、正常な組織と同様にLGR5を発現するがん細胞とKRT20を発現するがん細胞から構成されていることがわかっています。
研究グループは、患者さんから採取した大腸がん細胞を効率的に培養する技術を開発しました。特殊な方法でLGR5遺伝子発現を可視化し、1つのLGR5発現がん細胞が自分自身を産生し、分化した細胞を増やしながらがん組織を増大させることを確認しました。
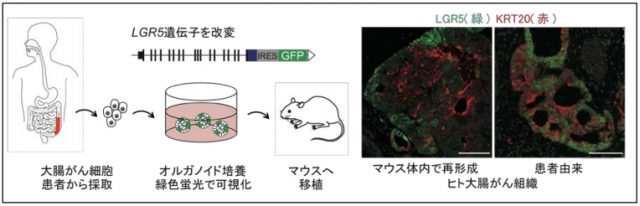
慶應義塾大学のプレスリリースから
次に、がん幹細胞を特異的に殺傷することでがんを根治できるかどうかを検証するために、遺伝子を操作して、特殊な薬剤でLGR5 発現大腸がん幹細胞だけを殺傷する治療モデルを開発しました。
その結果、この治療はがんの増大を食い止めることはできたものの、治療を中止するとがん細胞は再び増大しました。再増殖するがんの中には、殺傷したはずのLGR5発現がん幹細胞が再度出現しており、 がん幹細胞を殺傷するだけでは根源的治療が難しいことが示唆されました。
研究グループはさらに、がん幹細胞が殺傷された後でがんが再増殖する原因を調べ、完全にがん幹細胞を除去しても、分化したがん細胞が次々に新しいがん幹細胞に復活することを突き止めました。がん幹細胞治療だけを叩いてもがんの根治は難しいことがわかりました。
そこで、既存のがん治療薬とがん幹細胞標的治療を組み合わせ、その効果を検討しました。マウスにセツキシマブを投与すると、がんは縮小しましたが、根治には至りませんでした。セツキシマブ投与による治療ではがん幹細胞が生き残って、治療の中止後にがんが再発するためと考えられました。しかし、セツキシマブを投与した後にがん幹細胞標的治療を行うとがんは著しく縮小しました。
こうしたことから、がん幹細胞の殺傷だけでは治療効果は限定的であり、既存のがん治療薬とがん幹細胞標的治療を組み合わせることで根本的治療の可能性が示されました。
がんの根治治療の開発に期待
国内の大腸がんによる死亡者数は増加傾向にあります。女性では大腸がんが1位を占め(2015年度)、2020年には男性でも2位に上昇すると予測されています。現在、手術ができない状態の大腸がんに対する根本的な治療法は確立されておらず、新しい治療薬の開発が望まれています。
研究グループは「今回の研究成果から、今後、臨床で使用できるがん幹細胞標的治療薬や、分化がん細胞ががん幹細胞に戻るのを抑制して再発を予防する治療法など、新しいがんの根源的治療法の開発が期待される」としています。
【慶應義塾大学のプレスリリース】
https://www.keio.ac.jp/ja/press-releases/files/2017/3/31/170331-1.pdf
カテゴリー再発転移のがん治療を知る, その他治療
関連記事
※掲載している情報は、記事公開時点のものです。




